Mitochondrial hyperfusion via metabolic sensing of regulatory amino acids
Abdullah Mahmud O; Zeng Run X; Margerum Chelsea L; Papadopoli David; Monnin Cian; Punter Kaylee B; Chu Charles; Al-Rofaidi Mohammed; Al-Tannak Naser F; Berardi Domenica; Rattray Zahra; Rattray Nicholas JW; Abraham Sheela A; Eskelinen Eeva-Liisa; Watson David G; Avizonis Daina; Topisirovic Ivan; Chan Edmond YW
Mitochondrial hyperfusion via metabolic sensing of regulatory amino acids
Abdullah Mahmud O
Zeng Run X
Margerum Chelsea L
Papadopoli David
Monnin Cian
Punter Kaylee B
Chu Charles
Al-Rofaidi Mohammed
Al-Tannak Naser F
Berardi Domenica
Rattray Zahra
Rattray Nicholas JW
Abraham Sheela A
Eskelinen Eeva-Liisa
Watson David G
Avizonis Daina
Topisirovic Ivan
Chan Edmond YW
Cell Press
Julkaisun pysyvä osoite on:
https://urn.fi/URN:NBN:fi-fe2022091258634
https://urn.fi/URN:NBN:fi-fe2022091258634
Tiivistelmä
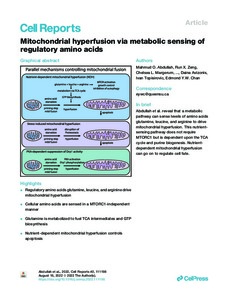
The relationship between nutrient starvation and mitochondrial dynamics is poorly understood. We find that cells facing amino acid starvation display clear mitochondrial fusion as a means to evade mitophagy. Surprisingly, further supplementation of glutamine (Q), leucine (L), and arginine (R) did not reverse, but produced stronger mitochondrial hyperfusion. Interestingly, the hyperfusion response to Q + L + R was dependent upon mitochondrial fusion proteins Mfn1 and Opa1 but was independent of MTORC1. Metabolite profiling indicates that Q + L + R addback replenishes amino acid and nucleotide pools. Inhibition of fumarate hydratase, glutaminolysis, or inosine monophosphate dehydrogenase all block Q + L + R-dependent mitochondrial hyperfusion, which suggests critical roles for the tricarboxylic acid (TCA) cycle and purine biosynthesis in this response. Metabolic tracer analyses further support the idea that supplemented Q promotes purine biosynthesis by serving as a donor of amine groups. We thus describe a metabolic mechanism for direct sensing of cellular amino acids to control mitochondrial fusion and cell fate.
Kokoelmat
- Rinnakkaistallenteet [29335]